产品背景
在细胞治疗产品的生产中,质粒/Minicircle DNA是DNA疫苗产品的主要成分之一,同时也是病毒载体或非病毒载体细胞免疫疗法的重要原料。在质粒制备菌株的生产过程中,大部分都是利用大肠杆菌进行发酵的,通过碱裂解反应,可以纯化得到DNA产品,但是在碱裂解反应的过程中,大肠杆菌会有大量的RNA释放出来,并随机断裂形成大小不一的RNA碎片。
生物制品中存在的RNA碎片会影响其生物学的活性,干扰质粒的转染表达效率;同时,RNA残留也会激活细胞干扰素通路引发免疫反应,对人体产生危害,因此需要建立RNA残留的定量检测方法,保证产品的质量和安全。
法规要求
《中华人民共和国药典》2020年版第三部人用基因治疗制品总论中规定,应建立基因治疗制品物理数量和生物数量的含量检测指标,可以通过诸如总颗粒数、感染性滴度或感染性颗粒数、基因组DNA/RNA或质粒DNA浓度等的检测来确定含量。
2022年5月,国家药品监督管理局药品评审中心(CDE)发布的《体内基因治疗产品要学研究与评价技术指导原则(试行)》中也明确指出需对生产工艺引入的工艺相关杂质,如宿主细胞RNA等纳入产品质量标准进行控制。


检测方法
目前中国药典2020版规定了三种残留核酸检测技术:DNA探针杂交法、荧光染色法、定量PCR法。其中定量PCR法通过荧光标记的特异性探针,监测体系中荧光数值的变化,即时反映特异性扩增产物量的变化。荧光强度达阈值时,PCR循环数与起始模板量的对数呈线性关系,采用已知浓度DNA标准品,构建标准曲线,就可以测定外源DNA残留量。测量结果灵敏度高特异性强。
鲲鹏基因自主研发的E.Coli总RNA残留检测试剂盒(PCR荧光探针法)配套有 E.coli RNA定量参考品,可快速准确定量检测各种生物制品的中间品、半成品和成品中E.coli宿主细胞RNA残留量。
产品特点
性能指标
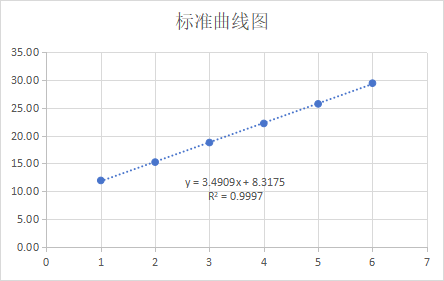
1 - 标准品线性
试剂盒线性范围为:2.00×10-3pg/μL ~2.00×102pg/μL,R2=0.9997,扩增效率为 93.40%,各浓度检测值 CV<15%。
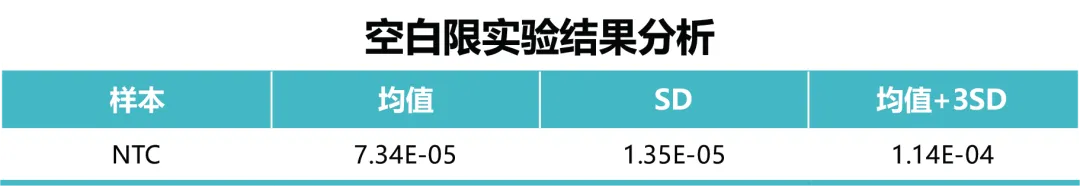
2 - 空白限
空白限的检测均值为 7.34×10-5 pg /μL,空白限确定为不大于 5.48×10-4 pg /μL。
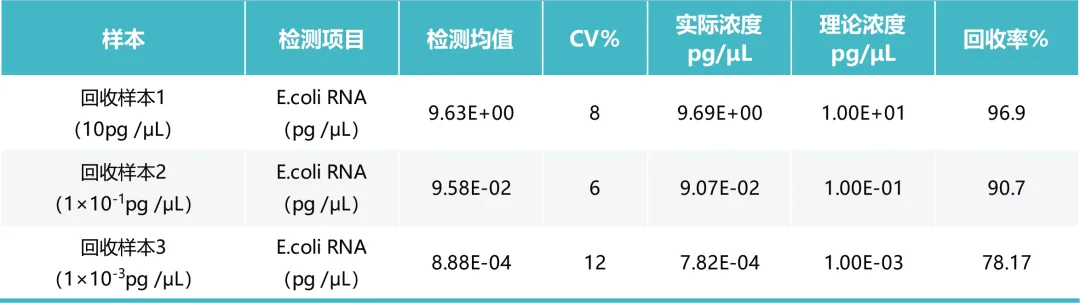
3 - 准确性
分别取 100μL 浓度为 1×10-3pg /μL、1×10-1pg /μL、10pg /μL样本进行 3 次检测,分析样本回收率和 CV。对于不同浓度 DNA 样本回收率均在 70%~130%之间,CV 均小于 15%。
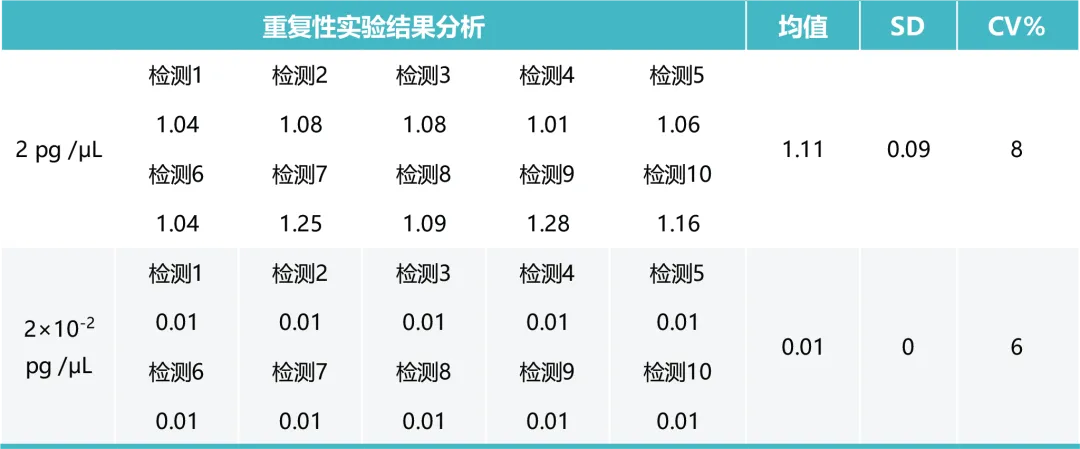
4 - 重复性
重复 10 次检测 2 pg /μL 和 2×10-2 pg /μL 的 E.coli RNA,CV 值<15%。
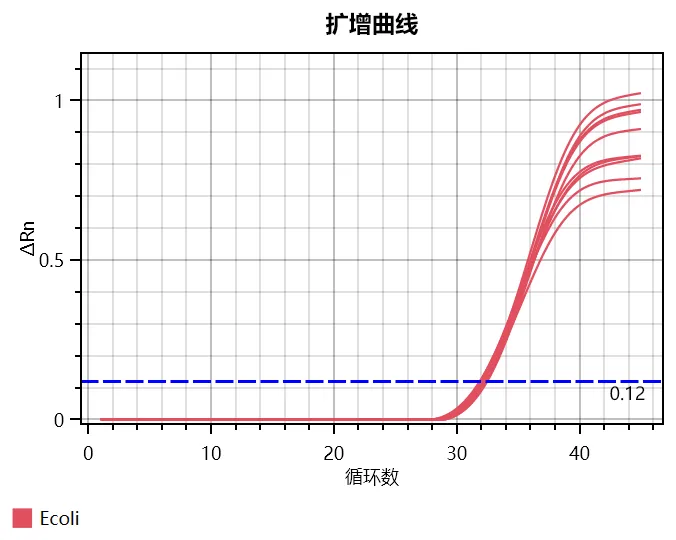
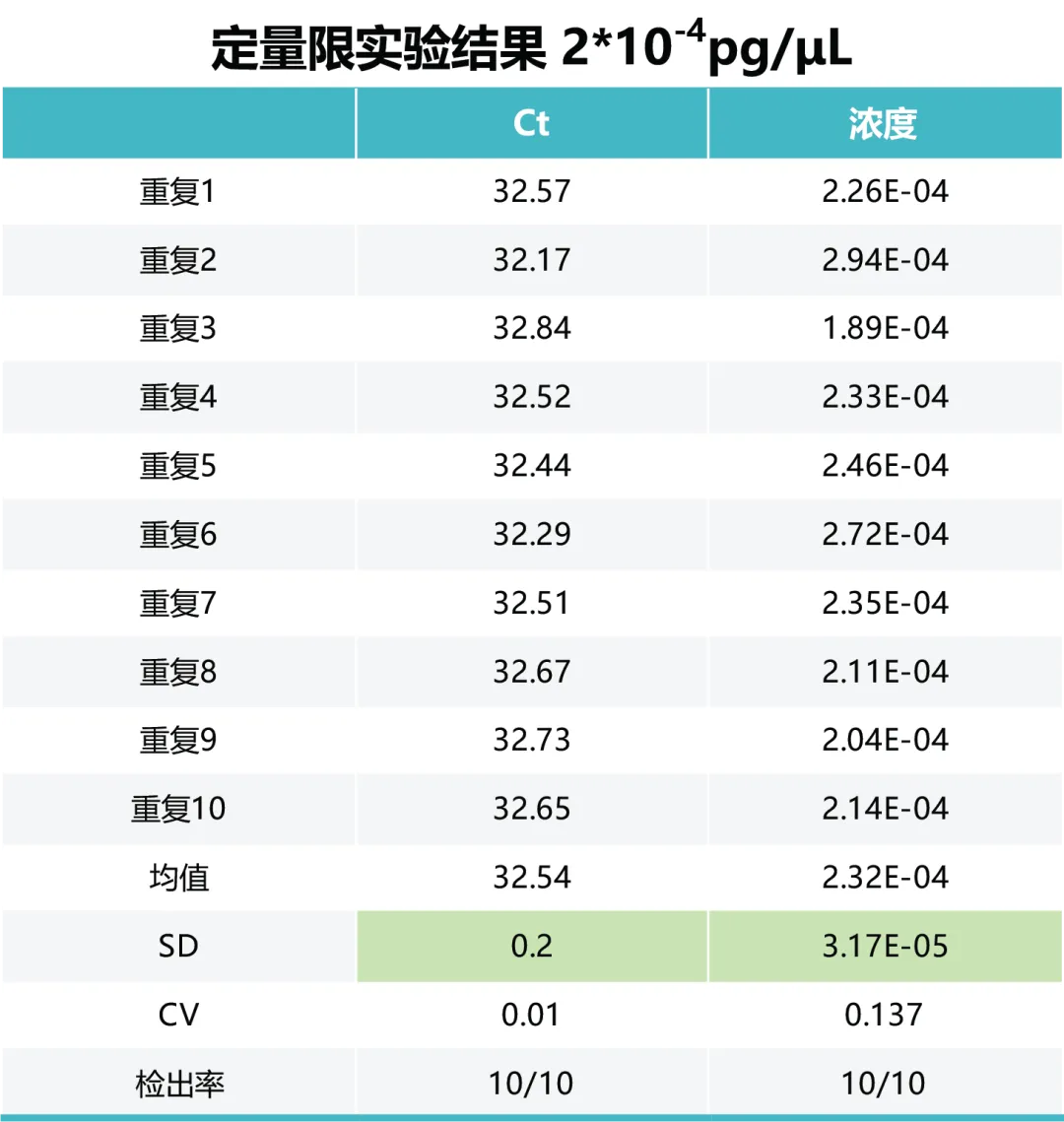
5 - 定量限
检测 5×10-3pg /μL、2×10-3pg /μL、1×10-3pg /μL、2×10-4pg/μL E.coli RNA,2×10-3pg /μL 及以上浓度 10个重复孔的 CV 值<20%。综上,E.coli 总 RNA 残留检测试剂盒的定量限可达 2×10-4pg/μL。
产品信息


